Использование клеточных биотехнологий в военной хирургии за рубежом (2017)
Капитан 2 ранга А. Ольгин
В настоящее время в вооруженных силах ведущих зарубежных государств важное значение придается совершенствованию высокотехнологичных методов лечения и реабилитации военнослужащих, получивших огнестрельные и минно-взрывные ранения, которые комбинируются с термическими поражениями.
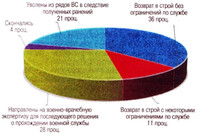
Так, по данным медицинской службы сухопутных войск (СВ) США, только до 36 проц. личного состава с боевой хирургической травмой возвращаются в строй полностью пригодными к исполнению обязанностей военной службы, а 11 проц. приобретают ряд ограничений по состоянию здоровья. Расчет финансовых затрат, проведенный Гарвардским университетом (штат Массачусетс), показывает, что в период до 2050 года расходы на пожизненные компенсационные выплаты военнослужащим, ставшими инвалидами, могут составить от 280 до 700 млрд долларов в зависимости от интенсивности и частоты задействования американских ВС в боевых действиях.
В интересах снижения таких затрат и увеличения числа лиц, годных к дальнейшему прохождению службы, Пентагон задействует наиболее современные достижения в области биотехнологий. Ведущим учреждением американского военного ведомства в указанной сфере является институт регенеративной медицины (ИРМ) ВС США (Armed Forces Institute of Regenerative Medicine).
Основная задача ИРМ -внедрение биоинженерных методов, позволяющих воссоздавать утраченные органы и кожный покров различных участков тела, а также заживлять глубокие раны без формирования рубцов. При этом большая часть исследований направлена на практическое использование стволовых клеток человека и их преобразование в полноценные в анатомическом и функциональном отношении структуры организма.
В настоящее время в этом научном центре ведутся работы по изучению путей восстановления функций поврежденных конечностей посредством профилактики раневой инфекции и ускорения процесса регенерации кожи, мышц и костей. Одновременно реализуется более 80 инновационных проектов в пяти областях.
Одной из перспективных разработок, представленной в феврале 2016 года в подразделении ИРМ - медицинском центре университета Уэйк-Форест, является 3D-биопринтер «Итоп» (Integrated Tissue-Organ Printer), который способен воспроизводить полноразмерные устойчивые и пригодные для трансплантации человеку органы и ткани.
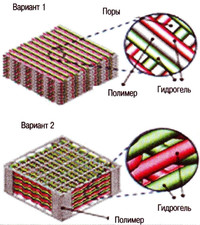
Процесс начинается с построения виртуальной модели. В соответствии с ней аппарат послойно создает трехмерные анатомические объекта, а затем покрывает их внешней оболочкой, которая позволяет напечатанным структурам сохранять форму. Для их формирования используется специальный гидрогель (комбинация желатина, фибриногена, гиалуроновой кислоты и глицерина с высокой концентрацией живых клеток) и биоразлагаемый полимерный материал, придающий тканям механическую прочность.
|
Таблица 1 Основные направления НИОКР ИРМ ВС США до 2011 года |
|
| Область исследования | Проекты исследований |
| Лечение ожоговой травмы | - Создание новых средств первой помощи при термических поражениях; - Использование стволовых клеток в восстановлении кожных покровов; - Разработка новых типов повязок для закрытия ожоговых поверхностей; - Применение биопринтеров и распылителей аэрозольного типа для нанесения клеточной массы на раневую поверхность; - Синтез биоинженерных заменителей кожи |
| Безрубцовое восстановление ран | - Разработка ранозаживляющего перевязочного материала, препятствующего образованию рубцов; - Создание биоматериала на основе клеток жировой ткани для восстановления мягких тканей челюстно-лицевой области и предотвращения развития Рубцовых деформаций; - Создание средств регуляции воспалительных процессов и образования келоидной ткани |
| Реконструкция тканей головы | - Конструирование иммуносовместимых трансплантатов для восстановления костных образований черепа и лица; - Разработка клеточных технологий восполнения дефектов мягких тканей челюстно-лицевой области; - Регенерация лицевых мышц; - Пересадка лица; - Воссоздание анатомического облика ушной раковины |
| Восстановление конечностей | - Передача нервных импульсов при обширных повреждениях; - Синтез структурных элементов костной ткани; - Создание устойчивых к механическому воздействию искусственных кровеносных сосудов; - Создание межклеточного материала в качестве питательной среды для мышечной регенерации; - Пересадки хрящей суставов и реконструкция околосуставных тканей; - Создание технологий пересадки утраченных конечностей; - Разработка способов регенерации пальцев рук |
| Лечение компартмент-синдрома* | - Применение стволовых клеток костномозгового происхождения; - Использование клеток-предшественниц мышечной ткани; - Реконструкция фасций; - Разработка препаратов для активной клеточной регенерации мышц |
| * Компартмент-синдром (синдром ишемического мионеврального дефицита) - патологическое состояние, возникающее в мышечной ткани вследствие повышения субфасциального давления | |
После пересадки тканей в организм это покрытие постепенно растворяется, а между клетками начинает самостоятельно образовываться матрикс - элемент, который выполняет каркасную функцию и обеспечивает обмен веществ. В настоящее время конструируемые таким способом ткани лишены кровеносных сосудов. Для доставки кислорода и питательных веществ предусмотрена сеть микроканалов диаметром 100-200 микрон, пронизывающих весь искусственный орган.
На практике продемонстрированы возможности изготовления костных фрагментов нижней челюсти и свода черепа на основе стволовых клеток человека, выделенных из околоплодной жидкости, а также уменьшенных копий человеческой ушной раковины из хондроцитов, нервных и мышечных волокон.
Все полученные образцы прошли испытания в лабораторных и естественных условиях. В созданном аналоге свода черепа спустя пять месяцев сформировалась пористая костная структура, подготовленная к внедрению кровеносных капилляров. Прототипы ушных раковин, пересаженные лабораторным животным, по истечении 60 сут не изменили свою анатомическую форму, и в них на 20 проц. увеличилось содержание компонентов соединительной ткани.
Искусственная мышца, вытянутая вдоль опорной конструкции, через 14 сут также приобрела присущие ей механические характеристики. Нервные пучки, вживленные в имплант, сохранили целостность, при этом наблюдалось формирование нейромышечных контактов.
В целях совершенствования указанных технологий в 2017-2018 годах намечено объединить усилия университетов Уэйк-Форест и Карнеги-Меллона, где разработана методика 3D-печати искусственных аналогов сердца, коронарных и бедренных сосудов, а также других сложных биологических объектов.
Помимо этого, к НИОКР института регенеративной медицины планируется привлечь исследователей Ливерморской лаборатории имени Лоуренса министерства энергетики США (штат Калифорния), которые в декабре 2015 года представили инновационный способ объемной биопечати кровеносных сосудов, с течением времени самостоятельно формирующих сеть капилляров.
Кроме того, в 2016 году в университете Висконсин впервые из клеток соединительнотканной и слизистой оболочек, взятых из человеческой гортани, были выращены голосовые связки, воспроизводящие звуки. Их поместили на макет дыхательных путей, через которые пропускали струю воздуха, имитируя голосообразование. Полученную звуковую информацию подвергли цифровой обработке, в результате чего было выяснено, что характеристики колебаний связок соответствуют показателям их природного аналога.
В последующих экспериментах оценивалась биосовместимость полученных тканей с живым организмом. В течение всего срока наблюдения за лабораторными животными (90 сут) отторжения пересаженных элементов не регистрировалось.
Таким образом, перспективная технология дает возможность выращивать данную анатомическую структуру для замены тканей, поврежденных в результате болезни или травмы.
Важное значение в ВС зарубежных стран придается разработке и совершенствованию биоинженерных трансплантатов (БТ), применяемых для оказания медицинской помощи военнослужащим, которые получили термические поражения и боевые травмы кожного покрова.
Все БТ по структуре подразделены на три типа: дермоэпидермалъные, обеспечивающие восстановление поврежденного кожного покрова на всю толщину; эпидермальные, позволяющие замещать поверхностный слой кожи; дермальные, предназначенные для формирования глубоких слоев.
По продолжительности покровной функции выделяют элементы трех типов: постоянного (устраняют дефект с последующей биоинтеграцией в состав формируемых тканей), временного (используются в течение определенного промежутка времени) и полупостоянного (сочетают в себе свойства двух предыдущих).
По составу БТ подразделяются на биологические (аутологичные - содержат материал тканей пациента, аллогенные - от других лиц, ксеногенные — от животных близких биологических видов), синтетические (биодеградируемые — состоят из усваиваемых организмом компонентов, небиодеградируемые - устойчивые к воздействию факторов защиты организма и смешанные.
Большинство дермоэпидермальных трансплантатов (ДЭТ) производится с помощью клеток эмбрионального происхождения, размещенных на подложке из коллагена или иного биологического субстрата, а также культуры аллогенных фибробластов (клетки дермального слоя кожи). Такое строение позволяет выпускать их относительно крупными партиями и создавать значительные запасы в лечебных учреждениях, рассчитанных на массовый прием раненых и пострадавших.
Вместе с тем ДЭТ используются лишь в качестве временной биологически активной повязки, так как наличие в составе чужеродных структур ограничивает их применение в качестве постоянного средства закрытия ожоговой поверхности. Кроме того, к недостаткам этих БТ относят высокую (до 30 долларов США на см2) стоимость и короткие (до 5 сут) сроки хранения, а также сложность создания биоинженерных конструкций, содержащих сочетания клеток различного происхождения.
На современном этапе активно ведутся НИОКР, направленные на получение ДЭТ постоянного типа, которые включают аутологичные фибробласты и клетки рогового слоя кожи - кератиноциты.
Наиболее совершенным считается ДЭТ, разработанный специалистами японского института «Рикен» и университета Токио. Данный трансплантат выращивается из «перепрограммированных» стволовых клеток. Его отличительной особенностью является наличие полноценно функционирующих волосяных фолликулов и желез внешней секреции, благодаря которым становится возможным процесс терморегуляции.
В апреле 2016 года начались испытания образцов ДЭТ на животных, а на 2017-й запланировано проведение клинических исследований с участием пациентов, имеющих обширные термические поражения. Внедрение инновации в хирургическую практику возможно не ранее 2020 года.
Производство эпидермальных трансплантатов (ЭТ) основано на культивировании кератиноцитов реципиента, полученных в ходе первичной хирургической обработки ожоговой поверхности. Благодаря современным методам с задействованием факторов клеточного роста и деления, а также замене синтетической пластиковой основы матрицей из фибрина стало реальным получение до 4 м2 таких тканей в течение 15 сут.
Вместе с тем, несмотря на преимущества применения аутологичных клеток пациента (исключение риска передачи инфекций через донорский материал, отсутствие иммунных реакций, приводящих к отторжению), ряд проблем, связанных с использованием данной технологии, остаются нерешенными.
Так, значительным препятствием для широкого внедрения в медицинскую практику аутологичных ЭТ является высокая степень дифференцировки входящих в их состав кератиноцитов. Они представлены преимущественно зрелыми популяциями клеток, которые практически утратили способность к экспрессии генов, ответственных за синтез белковинтегринов (это способствуют прикреплению пересаживаемой ткани к раневому ложу). Таким образом вероятность положительной пересадки трансплантата может варьироваться в широком диапазоне, а именно от 15 до 85 проц.
Еще одной серьезной проблемой остается ухудшение питания нижележащих клеток по мере образования межклеточных связей в более зрелых вышел ежащих кератиноцитовых пластах. Это может приводить к отсроченной (до 7 сут) отслойке и гибели ЭТ.
Новые подходы предполагают применение фибриновых и коллагеновых подложек-уплотнителей, прикрепляемых в ране специальными клеящими составами, а также пористых синтетических мембран, обеспечивающих надежную трофику всех слоев клеток. Еще одним вариантом является использование культивированных кератиноцитов пациента или донора в составе аэрозольных суспензий, что обеспечивает быстрое и надежное закрытие раневой поверхности.
Применение биоинженерных дермальных трансплантатов (ДТ) существенно повышает возможности последующего хирургического закрытия раневой либо ожоговой поверхности при помощи ЭТ. Большинство ДТ представляют собой бесклеточные конструкции, включающие аллогенные, ксеногенные или синтетические материалы.
В коммерческом отношении данный класс биоинженерных тканей характеризуется возможностью массового производства в предельно сжатые сроки. Это связано с отсутствием необходимости применения сложных технологий клеточного культивирования и сравнительно невысокой стоимостью исходного сырья.
К числу наиболее эффективных продуктов зарубежные специалисты относят аутологичный ДТ Hyalograft 3D итальянской фирмы «Фидия эдванст байополимерс», который в сочетании с ЭТ «Лазерскин» того же разработчика образует БТ постоянного типа TissueTech Autograft System. В ходе клинических испытаний изделие показало высокую степень эффективности при закрытии крупных дефектов кожного покрова.
При создании в зарубежных странах новых образцов дермальных трансплантатов значительное внимание уделяется внедрению практических достижений в области нанобиотехнологий. Помимо традиционных компонентов (клетки кожи, фибрин, коллаген, эластин) в составе перспективных конструкций намечено использование ферментов и других биологически активных соединений, играющих важную роль в процессах адаптации и роста тканей.
Таким образам, за рубежам, прежде всего в США и Японии, активно ведутся исследования в области клеточных биотехнологий и регенеративной медицины для повышения качества оказания хирургической помощи личному составу вооруженных сил. По оценкам зарубежных специалистов, широкое внедрение в клиническую практику новых биоинженерных методов с одновременным снижением их себестоимости обеспечит существенную экономию средств федерального бюджета при условии возврата в строй военнослужащих, получивших хирургические травмы и ранения.
|
Таблица 2 Перспективные зарубежные образцы дермоэпидермальных трансплантатов |
||
| Трансплантат | Состав | Разработчик |
| Аугологичный постоянного типа | Слой кератиноцитов и дерма с включением культуры фибробластов, сформированных волосяных фолликулов и желез внешней секреции | Институт «Рикен», университет Токио (Япония) |
| Аллогенный постоянного типа «Пермадерм» | Аутологичные кератиноциты и псевдодерма на основе коллагена I типа крупного рогатого скота с включением культуры ауталогичных фибробластов | Госпиталь «Цинциннати-Шринер» (США) |
| Аллогенный постоянного типа «Акудресс» | Культивированный слой кератиноцитов реципиента с подложкой-уплотнителем на основе фибрина | «ДиЭфБи фармасьютиклз» (США) |
| Аллогенный постоянного типа «Аллоко" | Суспензия аллогенных кератиноцитов и фибробластов в виде аэрозоля | «ДиЭфБи фармасьютиклз» (США) |
| Таблица 3 Перспективные зарубежные образцы эпидермальных трансплантантов | ||
| Трансплантат | Состав | Разработчики |
| Аугалогичный постоянного типа «Кэроселс" | Кератиноциты и фибробласты, полученные от реципиента и культивированные in vitro | «Кэроселл тисью инжиниринг», Каролинский университетский госпиталь (Швеция) |
| Аугалогичный постоянного типа «Аутодерм» | Непрерывный слой кератиноцитов, полученных от реципиента и культивированных in vitro | «Экселлентио (Бельгия), «Селлтран» (Великобритания) |
| Аугологичный временного типа «Трнансдерм» | Непрерывный слой кератиноцитов, полученных от реципиента и культивированных in vitro | «Экселлентио (Бельгия), «Селлтран» (Великобритания) |
| Аллогенный временного типа «Лифодерм» | Лиофильно высушенные неонатальные кератиноциты | «Экселлентио (Бельгия), «Селлтран» (Великобритания) |
| Аллогенный временного типа «Крайосил» | Неонатальные кератиноциты | «Экселлентио (Бельгия), «Селлтран» (Великобритания) |
|
Таблица 4 Перспективные зарубежные образцы ДТ |
||
| Трансплантат | Состав | Разработчик |
| Аллогенный временного типа Cyzact (ICX-PRO) | Фибриновый гель, содержащий культуру аллогенных фибробластов | «Интерсайтеко (Великобритания) |
| Аллогенный временного типа ICX-SKN | Матрица из человеческого коллагена, содержащая культуру аллогенных фибросластов | «Интерсайтекс» (Великобритания) |
| Ксеногенный постоянного типа Collatamp | Многослойная матрица из коллагена крупного рогатого скота | «Синтаколл» (Швейцария) |
| Аллогенный временного типа | Мембраны из нановолкон поликалронолактона, содержащие культуру аллогенных фибробластов | Национальный университет Сингапура |
| Аллоксеногенный временного типа «Tegaderm-nanofibre» | Наномембраны из сополимера эпсилон-капролактона и желатина, содержащие культуру аллогенных фибробластов, в сочетании с защитным псевдоэпидермальным полиуретановым покрытием | Национальный университет Сингапура |
| Аллоксеногенный временного типа | Матрица из коллагена I типа крупного рогатого скота и хондроитин-4-6-сульфатхитозана аллогенные фибробласты | Парижский университет (Франция) |
| Ксеногенный постоянного типа | Паста из бесхлеточной криоизмельченной дермы свиней, ковалентно связанной диизоцианитом | Научно-исследовательский фонд «Блонд МакИнду» (Великобритания) |
| Аллогенный постоянного типа | Губка из сополимера кератина человеческого волоса и коллагена | Южный медицинский университет (КНР) |
| Аллогенный постоянного типа | Матрица из гиалуроновой кислоты и фибронектина | Университет штата Нью-Йорк (США) |
| Синтетический постоянного типа | Мембранная основа из нановолокон полилактокогликолевой кислоты и хитозана | Тяньцэиньский университет (КНР) |
| Синтетический постоянного типа | Биодеградируемые полиуретановые микроволокна | Университет штата Делавэр (США) |
| Ксеногенный постоянного типа | Фиброин шелка и алгината | Национальный университет (Республика Корея) |
| Ксеногенный постоянного типа | Губка из поливинилалкоголя, хитозана и фиброина | Национальный институт сельского хозяйства и аграрных технологий (Республика Корея) |
| Аллогенный постоянного типа | Композитная наноматрица из оксида кремния и хитозана, импрегнированная желатином и гиалуроновой кислотой | Колледж здравоохранения и менеджмента (Тайвань) |
| Аллогенный постоянного типа | Матрица из нановолокон целлюлозы, синтезированных микроорганизмом | Гетебортский университет (Швеция) |
| Ксеногенный постоянного типа | Матрица из лиофильно высушенного коллагена крупного рогатого скота, содержащая трансглутаминазу микробного происхождения | Национальный университет Ирландии |